Thermodynamique des mélanges/Modèles de mélanges
Les systèmes réels sont souvent complexes à décrire et les physiciens simplifient le problème à résoudre en faisant des modèles qui tentent de représenter la réalité avec plus ou moins de précision.
Le modèle du gaz parfait
Les molécules d'un gaz parfait n'ont pas d'interactions entre elles et sont des objets ponctuels (sans volume).
Comme les molécules des gaz parfaits sont sans interactions (EXY = 0), alors il n'y aura pas d'effet thermique lors du mélange ( Qp = ΔHmél = 0 ) et il n'y aura pas d’attraction ou de répulsion entre les molécules A et B ( V = VA (pur) + VA (pur) ou ΔVmél = 0 ).
Pour un gaz parfait i , le potentiel chimique μi s'écrit:
On modifie cette relation en introduisant la pression totale Ptot:
on pose
et comme
- ,
alors
pour un mélange parfait de gaz parfaits, on aura donc l'enthalpie libre G telle que:
pour les gaz purs (séparés) on a :
donc
On calcule l'entropie de mélange en dérivant:
pour un mélange binaire A-B cela s'écrit:
et en divisant par ntot, on obtient:
|
|
Définition du paramètre d'interaction λ
Si on note EAA , EBB et EAB les énergies d'interaction entre deux molécules, alors on définit le paramètre d'interaction λ par:
|
|
Remarque = les énergies d'interaction entre deux molécules sont des grandeurs négatives ( E < 0 ).
- si λ = 0 avec EAA = EBB = EAB = 0 ; alors c’est le modèle du mélange de gaz parfaits.
- si λ = 0 avec EAA = EBB = EAB ≠ 0 et EAB = 0,5(EAA+EBB) ; alors c’est le modèle du mélange idéal.
- si λ < 0 alors |EAB| > 0,5|EAA + EBB| ; alors c’est un cas favorable pour la formation d'un mélange homogène.
- si λ > 0 alors |EAB| < 0,5|EAA + EBB| ; alors c’est un cas défavorable pour la formation du mélange, on pourra donc faire le mélange dans certaines conditions mais on pourra aussi avoir parfois un phénomène de démixtion ( i.e. séparation en deux phases ).
Le modèle du mélange idéal
Le modèle du mélange régulier et du mélange strictement régulier
Les mélanges réels
Les mélanges réels sont décrits par d'autres relations et l'on a pas en général la symétrie des courbes par rapport à x = 0,5 comme dans le cas des modèles précédents.
Les mélanges solides
Un mélange binaire solide homogène peut exister de deux manières:
- mélange solide de substitution
- mélange solide interstitiel
 |
 |
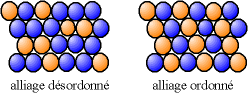
mélange solide de substitution
Les 2 solides doivent avoir la même structure cristalline et des rayon atomiques proches. Quand un des constituants est un métal, on parle d' alliages. Une substitution peut conduire, soit à un alliage désordonné, où les différents atomes occupent des positions aléatoires, soit à un alliage ordonné, où les atomes de différentes natures suivent une alternance régulière.
mélange solide interstitiel
Ici B doit avoir un rayon assez petit pour se glisser dans le réseau cristallin de A.
démixtion
On peut avoir formation de deux phases qui se répartissent dans le solide (cristallites).
Dans le cas des alliages, les phases à forte teneur en éléments d'alliage sont appelés « précipités ».
Les précipités sont souvent des alliages ordonnés, dits « intermétalliques ».
solution solide
On parle de solution solide quand un constituant est en excès (par exemple proche de 1).